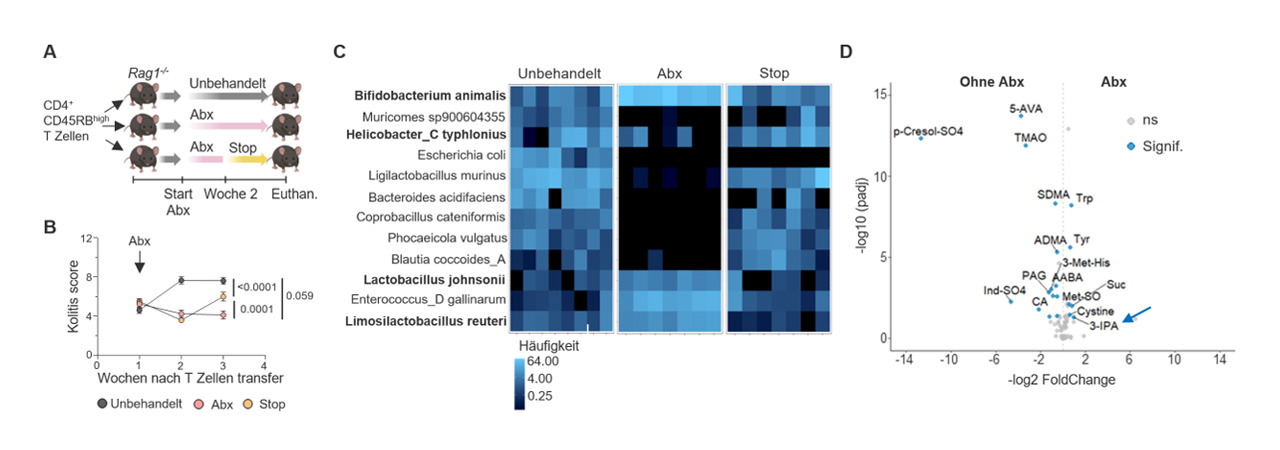
Bei Menschen mit Darmkrebs oder entzündlichen Darmerkrankung kann es zur Entfernung des Dickdarms und einer chirurgischen Anlage eines Stuhlreservoirs (Pouch) kommen. Etwa die Hälfte dieser Patientinnen und Patienten leiden im Verlauf unter einer Pouchitis, einer häufig wiederkehrenden schmerzhaften, chronischen Entzündung des operierten Darmabschnittes. Eine Behandlung mit Antibiotika ist in diesem Fall kurzzeitig sehr effektiv, was vermuten lässt, dass das die Modulation der Bakterien im Darm, auch Mikrobiota genannt, und deren Metaboliten ein außergewöhnliches therapeutisches Potential bei Behandlung von Entzündung der Darmschleimhaut hat.
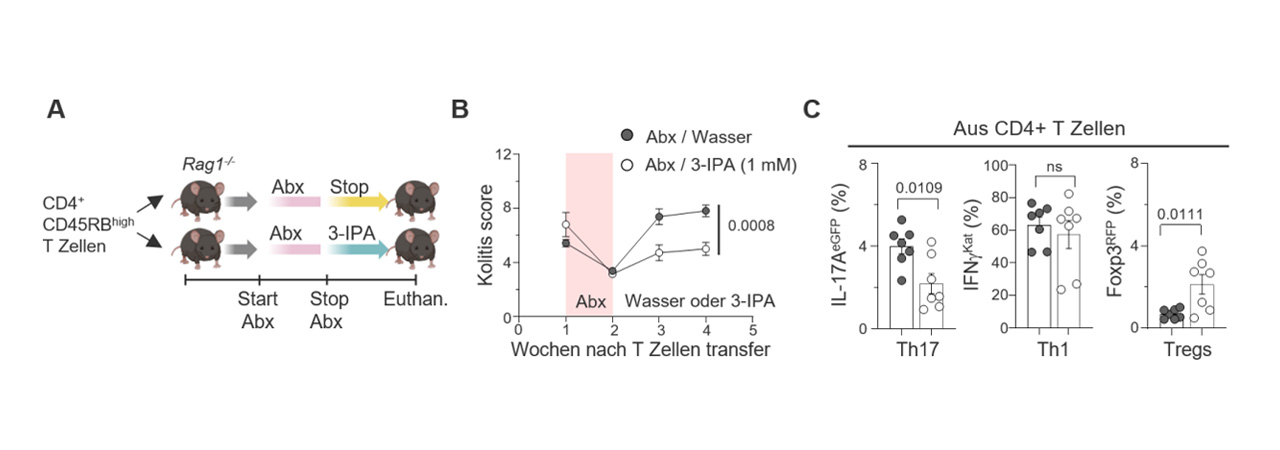
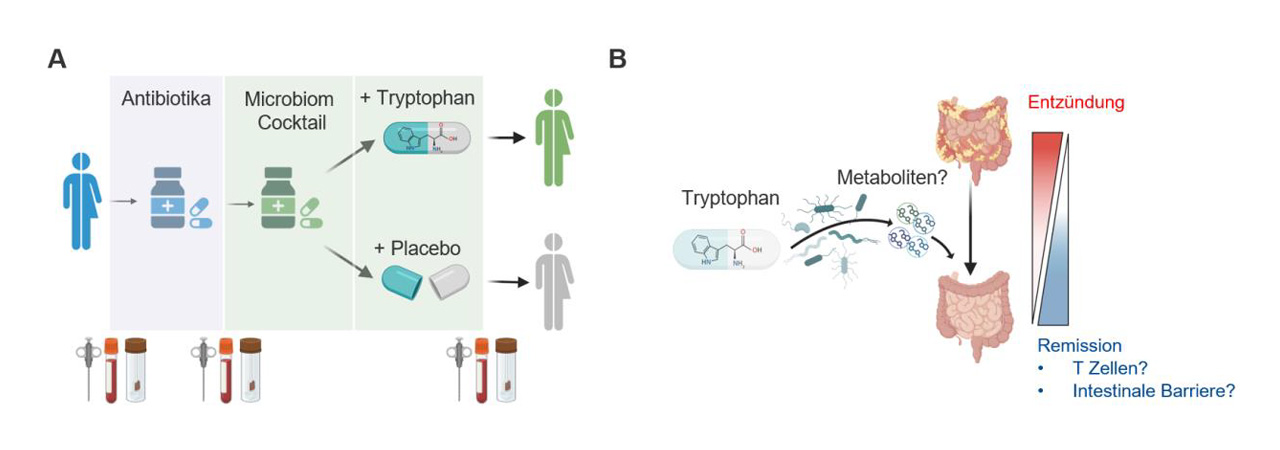
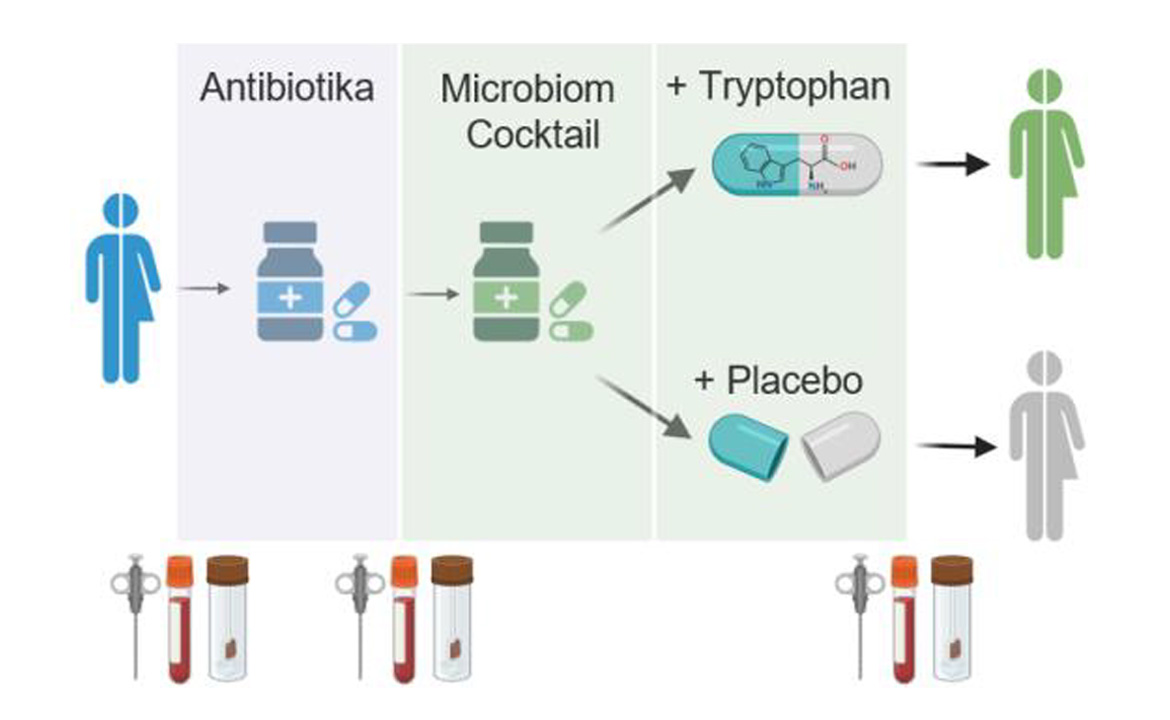
Erste Ergebnisse zeigen: Bestimmte Abbauprodukte des Eiweißbausteins Tryptophan, die von der Mikrobiota gebildet werden, können das Immunsystem gezielt regulieren und Entzündungen im Darm reduzieren. Auf dieser Basis wurde eine klinische Studie gestartet, in der eine Kombination aus Antibiotika, Probiotika und Tryptophan getestet wird – unter streng kontrollierten Bedingungen.
Ziel ist es, die genauen Wirkmechanismen dieser Immunregulation zu entschlüsseln und daraus neue Therapien zu entwickeln, die auch unabhängig vom Zustand der Mikrobiota wirken. Dafür werden Gewebe – und Blutproben aus der Studie analysiert und die Wirkung der Tryptophan-Metaboliten an patientenspezifischen Darmmodellen und Immunzellen untersucht.