Das maligne Melanom ist ein aggressiver bösartiger Tumor der Haut. In fortgeschrittenen Tumorstadien ist das maligne Melanom die häufigste tödlich verlaufende Hauterkrankung und für mehr als 90% der Todesfälle aller Hautmalignome verantwortlich. Der Erfolg moderner Krebstherapien basiert entscheidend auf der Infiltration von Immunzellen in das Tumorgewebe.
Bestimmte Zuckermoleküle an der Oberfläche von Krebszellen regulieren die Wechselwirkung der Zelle mit ihrer Umgebung. Eines der häufigsten Zuckermoleküle, welches von Melanomzellen produziert wird, ist das Heparansulfat (HS). Im Tumormikromilieu ist das HS maßgeblich für die Bildung neuer Blutgefäße und die Rekrutierung von Immunzellen verantwortlich. Genaue Einblicke in die Funktionsbeziehung zwischen der Struktur des HS und der biologischen Wirkung fehlen allerdings.
Ziel der Forschungsarbeit ist daher die Entschlüsselung der HS-Strukturen, die die Tumorentwicklung steigern oder hemmen. Eine Modulation der HS-Biosynthese soll die Rekrutierung tumorunterdrückender Immunzellen steigern. Die Ergebnisse sollen zur Verbesserung gegenwärtigen Krebstherapien beitragen.
Abschlussbericht
Hautkrebs – eine häufige Krebsart mit steigender Inzidenz
Hautkrebs gehört weltweit zu den häufigsten Krebsarten mit steigender Inzidenz. Gründe für eine steigende Zahl von Hautkrebs sind die alternde Bevölkerung und eine vermehrte Sonnenlichtexposition. Es können verschiedene Hautkrebsarten unterschieden werden; das maligne Melanom ist der vergleichsweise aggressivste Hautkrebstyp. Die Therapie des Melanoms beruht auf der chirurgischen Entfernung des betroffenen Hautareals und ist in einem frühen Stadium (vor der Metastasierung) für die betroffenen Patienten in der Regel kurativ. Bei einem fortgeschrittenen Tumorstadium, d.h. mit Metastasen in den Lymphknoten oder in distanten Organen wie dem Gehirn oder der Lunge, gab es bis vor wenigen Jahren keine gute Therapieoption und das mediane Überleben der Patienten lag bei ca. 7 Monaten. Mit der Einführung der Immuntherapien und insbesondere der Immune-Checkpoint Inhibitoren ist die Behandlung des fortgeschrittenen Melanoms deutlich verbessert worden. Das mediane Überleben hat sich mehr als verdoppelt und einige Patienten können vollständig geheilt werden. Von dieser positiven Entwicklung profitieren allerdings nur etwa 50 % der Patienten. Eine Verbesserung der Melanomtherapie und insbesondere wie die Ansprechrate der Patienten erhöht werden kann, war die Motivation dieses Forschungsprojektes.
Bedeutung des Tumormikromilieus für die Therapie
Der Erfolg der Immune-Checkpoint Inhibitoren beruht maßgeblich auf dem Tumormikromilieu (tumor microenvironment, TME). Das TME wird durch die Tumorzellen selbst, aber auch durch tumorassoziierte Zellen definiert. Neben den Endothelzellen spielen beim Melanom Immunzellen eine wesentliche Rolle im TME. Frühere Arbeiten haben gezeigt, dass Patienten, die auf eine Therapie mit Immune-Checkpoint Inhibitoren ansprechen, besonders viele tumorinfiltrierende T-Zellen haben. Patienten mit wenigen T-Zellen im Tumor zeigen kein oder nur ein geringes Therapieansprechen. Die Rekrutierung von Immunzellen wie den T-Zellen in den Tumor ist sehr komplex und beruht auf verschiedenen molekularen Mechanismen. Wesentlich scheinen Zytokine wie CXCL9 und CXCL10 beteiligt zu sein. Diese Zytokine vermitteln die Migration der T-Zellen aus dem Blut in den Tumor. Weitere wichtige Mediatoren sind Wachstumsfaktoren wie der vascular endothelial growth factor A (VEGFA), der für die Bildung neuer Blutgefäße im Tumor verantwortlich ist und somit eine wichtige Grundlage für den Transport von Immunzellen in den Tumor liefert.
Rolle der Glykosaminoglykane im Tumormikromilieu
Unsere früheren Arbeiten haben gezeigt, dass die biologische Funktion von VEGF-A, CXCL9 und CXCL10 über Glykosaminoglykane gesteuert wird. Glykosaminoglykane sind sogenannte Vielfachzucker. Im menschlichen Körper sind verschiedene Glykosaminoglykane, wie das Heparansulfat oder die Hyaluronsäure, verbreitet. Besonders das Heparansulfat (HS) scheint bei der Regulation von Proteinen im TME eine besondere Rolle zu spielen. Wir haben deswegen postuliert, dass das HS entscheidend für die Bildung des TME ist und somit eine wichtige Rolle bei der Rekrutierung von Immunzellen wie den T-Zellen spielt. Das HS wird von allen Säugetierzellen produziert. Die Synthese des HS scheint aber in Tumorzellen wie dem Melanom im Vergleich zu gesunden Zellen gestört zu sein. Die Synthese des HS ist sehr komplex und beruht auf mehr als 20 Enzymen. Eine veränderte Expression der Enzyme kann zu großen strukturellen Änderungen des HS führen, welche auch einen Einfluss auf die biologische Aktivität des HS haben kann. Wie die Struktur des HS das TME beeinflusst, ist bislang nur wenig erforscht und daher Gegenstand dieses Forschungsprojektes.
Struktur und Funktion von Heparansulfat (HS)
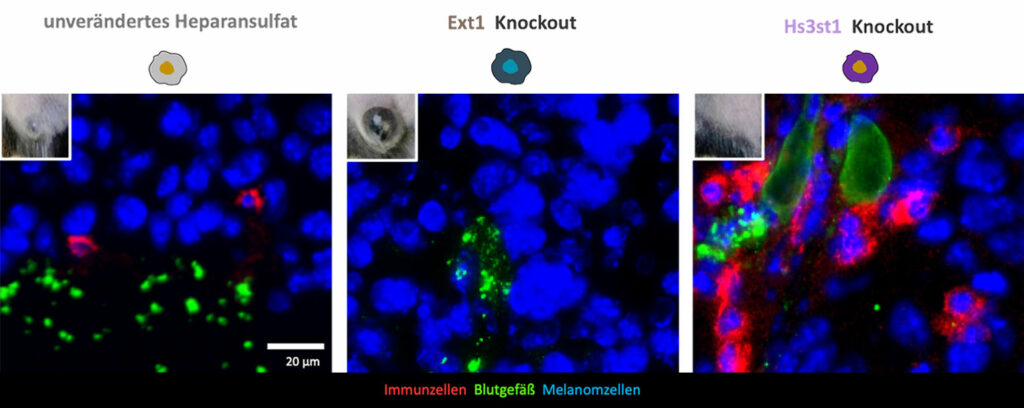
Wichtige strukturelle Parameter des HS sind der Grad und das Muster der Sulfonierung. Die Sulfonierung wird durch sogenannte Sulfotransferasen während der HS-Biosynthese katalysiert. Durch den gezielten Knockout dieser Sulfotransferasen konnten wir Melanomzellen generieren, die klar definierte strukturelle Änderungen im HS aufwiesen. Im Rahmen des Projektes haben wir die so hergestellten Zelllinien charakterisiert. Neben den Standardverfahren wie der Durchflusszytometrie oder der Disaccharidkompositionsanalyse konnten wir mit Hilfe der Projektförderung ein neues Verfahren zur Charakterisierung von HS auf den Oberflächen von Melanomzellen etablieren [Großdorf et al. Proteoglycan Research, 2025]. Bei diesem Verfahren haben wir die Melanomzellen simultan mittels super-resolution light microscopy und single molecule force spectroscopy vermessen. Im Vergleich zu anderen Methoden ermöglicht dieses Verfahren neben der Bestimmung der HS-Kettenlänge auch Einblicke in die Domainstruktur des HS und wie das HS mit Proteinen wie Zytokinen oder Wachstumsfaktoren interagiert. Zudem zeigte dieses Verfahren, dass eine Veränderung der 6-O Sulfonierung die Domainstruktur des HS stark beeinflusst und damit auch die Interaktion mit HS-bindenden Proteinen reduziert.
Biologische Relevanz der HS-Modifikation im Tumor
Die biologische Relevanz dessen zeigte sich bei entsprechenden in vivo Experimenten. Mäuse, die mit Tumorzellen, welche HS ohne 6-O Sulfonierung produzieren, sind in der Maus signifikant schlechter gewachsen und die entstandenen Tumore waren stark mit zytotoxischen CD8+ T-Zellen infiltriert. Ähnliche Ergebnisse fanden wir in Tumoren, denen die 3-O Sulfatgruppen fehlten. Transkriptionsanalysen zeigten, dass diese Änderung des HS mit einer signifikant höheren Expression von CXCL9 im Tumorgewebe einherging. Allerdings scheinen nicht alle Sulfonierungen im Hinblick auf die Infiltration von T-Zellen eine Rolle zu spielen. Änderungen in der 2-O oder der N-Sulfonierung hatten kaum einen Einfluss auf die Menge an T-Zellen im Tumor. Für eine noch detailliertere Analyse der involvierten molekularen Signalwege wird gegenwärtig das Kinom der Tumorzellen analysiert.
Schlussfolgerungen und klinische Perspektiven
Im Rahmen des Projektes konnten wir zeigen, dass die Enzyme HS6ST1 (6-O Sulfonierung) und HS3ST1 (3-O Sulfonierung) maßgeblich die Rekrutierung von T-Zellen in das Tumorgewebe steuern. Die damit assoziierten strukturellen Änderungen des HS scheinen unter anderem einen Einfluss auf das Zytokin CXCL9 zu haben. Im klinischen Kontext scheint eine tumorspezifische Inhibition dieser Enzyme sinnvoll, um die Menge von T-Zellen im Tumor zu erhöhen. Eine therapeutische Gabe entsprechender Inhibitoren erscheint insbesondere bei Patienten, die nicht auf Immune-Checkpoint Inhibitoren ansprechen, sinnvoll.